Inhaltsverzeichnis
Von Torsten Liem & Winfried Neuhuber
Vergleichende anatomische und funktionelle Studien sprechen gegen die postulierte phylogenetische Verwurzelung der Polyvagaltheorie (PVT). Auch ist die Bezeichnung „polyvagal“ im neuroanatomischen Konstrukt der PVT und im funktionellen Konstrukt des Systems des sozialen Engagements irreführend, da der Begriff impliziert, dass ein „neuer“ ventraler Vagalkomplex neben einem „alten“ dorsalen koordinierende Funktion ausüben würde. Der N. vagus ist sicherlich ein wichtiger Faktor im System des sozialen Engagements (in das der N. hypoglossus einbezogen werden sollte), aber er ist nicht der Koordinator. Vielmehr koordiniert das mesenzephale periaquäduktale Grau zusammen mit dem limbischen System und neuronalen Hirnstammnetzwerken Verhaltenszustände wie Kampf und Flucht sowie Freezing – mit den dazugehörigen motorischen, vegetativen und endokrinen Auswirkungen. Letztlich wirken zahlreiche andere Hirnbereiche, wenn nicht gar das gesamte Gehirn als System des sozialen Engagements. Folglich wäre eine Neuformulierung, zumindest aber eine klärende Neubezeichnung indiziert.
1.1 Die Polyvagaltheorie
Seit ihrer ersten Beschreibung durch Stephen Porges im Jahr 1995 [1][2] hat die Polyvagaltheorie (PVT) weltweit viel Beachtung unter Mind-Body-Therapeuten inkl. der Osteopathie gefunden, insbesondere im Hinblick auf die Behandlung von Traumapatienten. Die PVT ist ein Versuch, die Beziehung zwischen parasympathischer Aktivität und Verhalten aus einer evolutionären Perspektive zu erklären [3]. Sie zielt darauf ab, ein Verständnis für die Verbindungen zwischen den Prozessen des Gehirns und des Körpers zu schaffen [1][2].
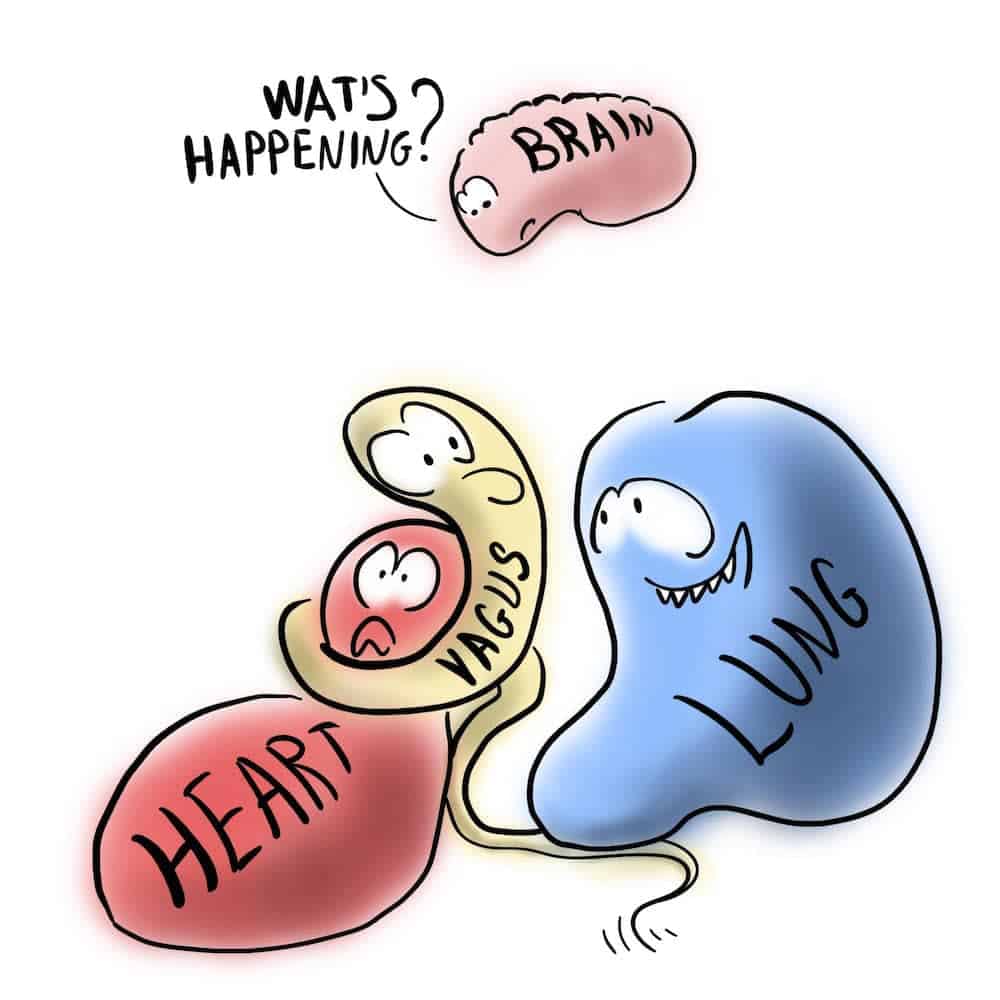
Der Begriff „polyvagal“ bezieht sich auf 2 vagale Schaltkreise. Das eine ist das phylogenetisch ältere unmyelinisierte System, das durch den motorischen Nucleus dorsalis n. vagi repräsentiert wird, der hauptsächlich subdiaphragmale Organe (v.a. den Gastrointestinaltrakt), aber auch das Herz innerviert und mit Immobilisierung und Dissoziation verbunden ist. Evolutionär jünger soll sich laut Porges ein 2. jüngerer vagaler Pfad entwickelt haben, der nur bei Säugetieren, nicht aber bei Reptilien beobachtet wurde und die Fähigkeit besitzt, Immobilisations- sowie Kampf- und Flucht-Verhalten herunterzuregulieren. Die anatomischen Strukturen dieser Komponente des Vagus interagieren laut Porges im Hirnstamm mit Strukturen, welche die quergestreiften Muskeln des Gesichts und des Kopfs innervieren, um ein integriertes System des sozialen Engagements zu schaffen [4]. Dieses jüngere System wird insbesondere durch den Nucleus ambiguus repräsentiert. In der PVT wird er mit den übrigen branchiomotorischen (speziell viszeroefferenten) Kernen des V., VII., IX. und XI. Hirnnervs als ventraler Vagalkomplex bezeichnet [5]. Dieses System reguliert über myelinisierte Nervenfasern Herz und Lunge, um Ruhezustände zu ermöglichen, und soll mit Sicherheits- und Sozialverhalten assoziiert sein [6].
Der Schwerpunkt der PVT liegt auf der phylogenetischen Verschiebung zwischen Reptilien und Säugetieren, die sich in spezifischen Veränderungen der vagalen Bahnen, die das Herz regulieren, ergab. Demzufolge verlagerten sich primäre vagale efferente Leitungsbahnen, die das Herz regulieren, vom dorsalen Kern des Vagus bei Reptilien zum Nucleus ambiguus bei Säugetieren, sodass sich eine Gesichts-Herz-Verbindung mit Eigenschaften eines Systems des sozialen Engagements etablieren konnte, das es ermöglicht, dass soziale Interaktionen den viszeralen Zustand und viszerale Funktionsstörungen, die sich in der neuronalen Regulation des Herzens manifestieren, beeinflussen [7].
1.2 Vergleichende anatomische und funktionelle Studien mit Bezug zur PVT
Diese Studien sprechen gegen die vorgeschlagene phylogenetische Basis der PVT. Unbestritten ist, dass bei Säugern myelinisierte kardioinhibitorische Axone aus dem Nucleus ambiguus entspringen. Doch bereits bei Knorpelfischen (Elasmobranchiern, z. B. Haien), die seit 400 Millionen Jahren existieren, sind die kardioinhibitorischen Vagusneuronen myelinisiert und leiten mit Geschwindigkeiten zwischen 7 und 35 m/s (was den B-Fasern von Säugetieren entspricht). Zudem liegen ihre Zellkörper an 2 verschiedenen Stellen im Hirnstamm (dorsaler Vaguskern und Primordium des Nucleus ambiguus) [8][9]. Somit sind bereits Knorpelfische „polyvagal“.
Auch Lungenfische, die in der Evolution als Vorläufer der Luft atmenden Tiere gelten, verfügen über einen myelinisierten kardialen Vagusnerv, der seinen Ursprung in dorsalen und ventrolateralen Hirnstammkernen hat [10]. Diese myelinisierten, schnell leitenden Axone ermöglichen die Verlangsamung der Herzfrequenz von Schlag zu Schlag, die für die bei diesen alten Wirbeltieren beobachteten kardiorespiratorischen Interaktionen zwingend erforderlich ist, ähnlich wie bei der respiratorischen Sinusarrhythmie von Säugetieren [10][11].
Die nicht myelinisierten vagalen Herzneuronen des Nucleus dorsalis n. vagi haben höchstwahrscheinlich keinen signifikanten Einfluss auf die Herzfrequenz und können daher nicht für eine Bradykardie, wie sie beim Freezing-Zustand beobachtet wird, verantwortlich gemacht werden. Sie scheinen die ventrikuläre Inotropie zu beeinflussen und könnten die Kardiomyozyten vor einer Ischämie schützen [12].
1.3 Reaktionsmuster bei der PVT
Die PVT ordnet die Reaktionen auf wahrgenommene Risiken 3 Kategorien zu: sich sicher fühlen, in Gefahr sein oder eine Bedrohung für das Leben empfinden. Diese Kategorien folgen in der Phylogenese aufeinander. Sie stehen im Zusammenhang mit den adaptiven Verhaltensweisen der sozialen Kommunikation (Mimik, Sprechen, Zuhören), die vom Nucleus ambiguus kontrolliert werden sollen, sowie mit der Verteidigung im Sinne der Mobilisierung (Kampf, Flucht) und der Immobilisationsreaktion (vasovagale Synkope, Dissoziation, Immobilisations- bzw. Freezing-Zustand), die vom Nucleus dorsalis n. vagi kontrolliert werden [1][6][12][13][14].
Auch hier ist die vorgeschlagene Verbindung dieser Verhaltensphänomene mit dem alten nicht myelinisierten bzw. dem neuen myelinisierten Vagusnerv irreführend. Der Nucleus ambiguus der Säuger enthält neben den kardioinhibitorischen Neuronen v.a. allem die branchiomotorischen (speziell viszeroefferenten) Neurone für Larynx-, Pharynx- und quergestreifte Ösophagusmuskulatur [15], kontrolliert jedoch weder den Gesichtsausdruck (mimische Muskeln werden durch den N. facialis innerviert) noch das Hören über die Mittelohrmuskeln (M. tensor tympani, innerviert durch den motorischen Zweig des Trigeminusnervs, und M. stapedius, innerviert durch den N. facialis) noch andere Kopf- und Halsmuskeln, wie von der PVT vorgeschlagen. Auch beeinflusst der Nucleus facialis umgekehrt nicht den Nucleus ambiguus.
All diese motorischen Kerne, einschließlich des Hypoglossuskerns, werden durch prämotorische Netzwerke in der lateralen parvozellulären und intermediären retikulären Formation koordiniert [16][17][18][19][20]. Die zwischen dem medialen magnozellulären und dem lateralen parvozellulären Bereich gelegene intermediäre Formatio reticularis beherbergt darüber hinaus die neuronalen Netzwerke für die kardiovaskuläre Regulation (Kreislaufzentrum) und die zentralen Generatoren für Atemrhythmus (Prä-Bötzinger-Komplex, Atemzentrum) sowie für Schlucken und Erbrechen. Nucleus dorsalis n. vagi und Nucleus ambiguus sind in diese Netzwerke anatomisch und funktionell eingebettet, jedoch nicht als Koordinatoren, sondern als Output-Elemente. Vagale Afferenzen sind über den Solitariuskern (Nucleus tractus solitarii) nicht nur mit den motorischen Vaguskernen (Nucleus dorsalis n. vagi und Nucleus ambiguus) verbunden, sondern auch mit den prämotorischen Netzwerken der Formatio reticularis sowie dem Kreislauf- und Atemzentrum [20]. Ebenso wichtig für die Koordination der gesamten Kopf-Hals-Motorik sind aber auch trigeminale und obere zervikale spinale Afferenzen, die ebenfalls den prämotorischen retikulären Netzwerke zugeleitet werden.
1.4 Rolle des mesenzephalen periaquäduktalen Grau (PAG)
Ein bilateraler periventrikulärer Kern im ventralen Mesenzephalon, der eine ähnliche Lage wie das PAG der Säuger zeigt, wurde bereits beim Neunauge, das zur ältesten heute lebenden Gruppe von Wirbeltieren gehört, beschrieben [21]. Verhaltenszustände wie Kampf und Flucht, Immobilisations- bzw. Freezing-Zustand und Risikoabschätzung – mit den dazugehörigen motorischen, vegetativen und endokrinen Auswirkungen – werden durch das mesenzephale periaquäduktale Grau (PAG) koordiniert [22][23][24][25]. Das PAG ist mit dem Hypothalamus und dem limbischen System (v.a. der Amygdala und dem präfrontalen Kortex) [23][24] sowie mit verschiedenen prämotorischen und vegetativen Hirnstammkernen verbunden, welche die Atmung und das emotionale motorische System koordinieren [25]. Das PAG empfängt Afferenzen von fast allen sensorischen Systemen – nicht zuletzt vom nozizeptiven System – und moduliert deren Verarbeitung [24].
Zweifellos hat der N. vagus aufgrund seines großen afferenten Anteils einen signifikanten Einfluss auf Emotionen und verschiedene Verhaltenszustände. Vagale Afferenzen, die etwa 80% seiner Axone ausmachen, werden durch den Nucleus tractus solitarii zu PAG, Hypothalamus, Amygdala sowie zum insulären, zingulären und präfrontalen Kortex weitergeleitet, wo sie in emotionale und kognitive Prozesse integriert werden [26][27][28][29]. Neuere Studien deuten darauf hin, dass subdiaphragmale vagale Afferenzen die angeborene Angst, erlernte Furcht und andere Verhaltensweisen beeinflussen [30][31]. Darüber hinaus modulieren vagale Afferenzen in verschiedenen experimentellen Modellen spinale nozizeptive Prozesse [32][33].
Zwar wird bei Porges [34] die Darstellung von neuroanatomisch bereits lange bekannten Relationen des limbisches Systems und PAG mit den bidirektionalen Verbindungen zum Vaguskomplex erwähnt. Da aber nicht der ventrale Vaguskomplex, sondern das PAG im Verein mit limbischen und anderen Hirnstammnetzwerken als Koordinator für diese Verhaltenszustände verantwortlich ist und außerdem zahlreiche Hirnbereiche, wenn nicht das gesamte Gehirn als System des sozialen Engagements fungieren, erscheint der Begriff „polyvagal“ zu seiner Charakterisierung als eine irreführende Fehlbezeichnung.
1.5 Fazit
Wie bereits Grossman und Taylor [11] zeigten, sind phylogenetische Bezüge als Basis für die PVT fragwürdig. Auch Tatsachen der Hirnnervenanatomie werden in der PVT teilweise inkorrekt dargestellt. Statt den Begriff des ventralen Vagalkomplexes auf alle branchiomotorischen Kerne auszudehnen, wäre es sinnvoller, ihnen ihre Eigenständigkeit zu belassen und ihre Koordination durch ein Netzwerk von Hirnstammneuronen zu betonen.
Das Konzept des Systems des sozialen Engagements ist plausibel und erscheint praxisrelevant. Irreführend ist jedoch und sollte vermieden werden, es mit dem „alten unmyelinisierten bzw. neuen myelinisierten Vagus“ und dem Begriff „polyvagal“ zu verknüpfen. Zudem sollte ins Konzept des Systems des sozialen Engagements auch der N. hypoglossus, der zwar kein branchiomotorischer Nerv ist, doch die sozial wichtige Zungenmuskulatur innerviert, einbezogen werden.
Auch dem mesenzephalen Trigeminuskern und anderen sensorischen Trigeminuskernen kommen eine große Bedeutung für die Koordination der orofazialen Motorik zu. Der N. vagus ist efferent wie auch afferent sicher ein wichtiger Faktor im System des sozialen Engagements. Da der „neue“ N. vagus in Gestalt des Nucleus ambiguus jedoch keine koordinierende Funktion auf die anderen branchiomotorischen Kerne (V, VII, IX, XI) ausübt, auch wenn vagale Afferenzen über den Nucleus tractus solitarii in diese Koordinationsnetzwerke eingespeist werden, stellt die PVT die kausalen Zusammenhänge auf den Kopf. Die Bezeichnung „polyvagal“ ist demzufolge eine irreführende Fehlbezeichnung. Das funktionelle Konstrukt des Systems des sozialen Engagements sollte nicht mit dem Begriff „polyvagal“ verbunden werden. Eventuell wäre eine klärende Neubezeichnung indiziert.
Literatur
1. Porges SW. The polyvagal theory: phylogenetic substrates of a socialnervous system. Int J Psychophysiol 2001; 42 (2): 123–146
2. Porges SW. The polyvagal theory: phylogenetic contributions to socialbehavior. Physiol Behav 2003; 79 (3): 503–513
3. Porges SW. The polyvagal perspective. Biol Psychol 2007; 74 (2): 116–143
4. Porges SW, Dana D. Clinical Applications of the Polyvagal Theory: The Emergence of Polyvagal-Informed Therapies. New York: WW Norton; 2018
5. Porges SW. Social engagement and attachment: a phylogenetic perspective. Ann N Y Acad Sci 2003; 1008: 31–47
6. Porges SW. The Polyvagal Theory: Neurophysiological foundations of emotions, attachment, communication, and self-regulation. New York, NY: Norton; 2011
7. Porges SW, Kolacz J. Neurocardiology through the lens of the polyvagal theory. In: Gelpi RJ, Buchholz B. Neurocardiology: Pathophysiological Aspects and Clinical Implications. Elsevier; 2018
8. Barrett DJ, Taylor EW. The location of cardiac vagal preganglionicneurones in the brain stem of the dogfish Scyliorhinus canicula. J Exp Biol 1985; 117: 449–458
9. Barrett DJ, Taylor EW. The characteristics of cardiac vagal preganglionic motoneurones in the dogfish. J Exp Biol 1985; 117: 459–470
10. Monteiro DA, Taylor EW, Sartori MR et al. Cardiorespiratory interactions previously identified as mammalian are present in the primitive lungfish. Sci Adv 2018; 4 (2): eaaq0800
11. Grossman P, Taylor EW. Toward understanding respiratory sinusarrhythmia: relations to cardiac vagal tone, evolution and biobehavioral functions. Biol Psychol 2007; 74: 263–285
12. Porges SW. Love: an emergent property of the mammalian autonomic nervous system. Psychoneuroendocrinology 1998; 23: 837–861
13. Porges SW. The polyvagal perspective. Biol Psychol 2007; 74: 116–143
14. Porges SW. The polyvagal theory: new insights into adaptive reactions of the autonomic nervous system. Cleve Clin J Med 2009; 76 (suppl 2): S86–S90
15. Fritzsch B, Elliott KL, Glover JC. Gaskell revisited: new insights into spinal autonomics necessitate a revised motor neuron nomenclature. Cell Tissue Res 2017; 370: 195–209
16. Fay RA, Norgren R. Identification of rat brainstem multisynaptic connections to the oral motor nuclei using pseudorabies virus: I: Masticatory muscle motor systems. Brain Res Brain Res Rev 1997; 25 (3): 255–275
17. Fay RA, Norgren R. Identification of rat brainstem multisynaptic connections to the oral motor nuclei in the rat using pseudorabies virus: II: Facial muscle motor systems. Brain Res Brain Res Rev 1997; 25 (3): 276–290
18. Fay RA, Norgren R. Identification of rat brainstem multisynaptic connections to the oral motor nuclei using pseudorabies virus: III: Lingual muscle motor systems. Brain Res Brain Res Rev 1997; 25 (3): 291–311
19. Travers JB, Norgren R. Afferent projections to the oral motor nuclei in the rat. J Comp Neurol 1983; 220 (3): 280–298
20. Büttner-Ennever JA, Horn AKE. Solitary nucleus (SOL). In: Büttner-Ennever JA, Horn AKE. Olszewski and Baxter’s Cytoarchitecture of the Human Brainstem. 3. Aufl. Basel: Karger; 2014
21. Olson I, Suryanarayana SM, Robertson B, Grillner S. Griseum centrale, a homologue of the periaqueductal gray in the lamprey. IBRO Rep 2017; 2: 24–30
22. Deng H, Xiao X, Wang Z. Periaqueductal gray neuronal activities underlie different aspects of defensive behaviors. J Neurosci 2016; 36 (29): 7580–7588
23. Roelofs K. Freeze for action: neurobiological mechanisms in animaland human freezing. Philos Trans R Soc Lond B Biol Sci 2017; 372 (1718): 20160206
24. Jänig W. The integrative action of the autonomic nervous system. Cambridge: Cambridge University Press; 2006
25. Holstege G. The periaqueductal gray controls brainstem emotional motor systems including respiration. Prog Brain Res 2014; 209: 379–405
26. Craig AD. How do you feel? Interoception: the sense of the physiological condition of the body. Nat Rev Neurosci 2002; 3 (8): 655–666
27. Critchley HD, Mathias CJ, Dolan RJ. Neuroanatomical basis for first and second-order representations of bodily states. Nat Neurosci 2001; 4 (2): 207–212
28. Saper CB. The central autonomic nervous system: conscious visceral perception and autonomic pattern generation. Annu Rev Neurosci 2002; 25: 433–469
29. Berthoud HR, Neuhuber WL. Functional and chemical anatomy of the afferent vagal system. Auton Neurosci 2000; 85 (1–3): 1–17
30. Klarer M, Arnold M, Günther L et al. Gut vagal afferents differentially modulate innate anxiety and learned fear. J Neurosci 2014; 34 (21): 7067–7076
31. Klarer M, Krieger JP, Richetto J et al. Abdominal vagal afferents modulate the brain transcriptome and behaviors relevant to schizophrenia. J Neurosci 2018; 38: 1634–1647
32. Foreman RD, Qin C, Jou CJ. Spinothalamic system and viscerosomatic motor reflexes: functional organization of cardiac and somatic input. In: King HH, Jänig W, Patterson MM. The science and clinical application of manual therapy. Edinburgh: Churchill Livingstone; 2011: 11–127
33. Jänig W, Green P. Acute inflammation in the joint: its control by the sympathetic nervous system and neuroendocrine systems. Auton Neurosci 2014; 182: 42–54
34. Porges SW. Social engagement and attachment: a phylogenetic perspective. Ann N Y Acad Sci 2003; 1008: 31–47