Von Torsten Liem & Miriam Havel
Zusammenfassung
In diesem Artikel wird die Bedeutung des suprachiasmatischen Nukleus (SCN) für die tagesrhythmische Regulation des intrinsischen Zeitprogramms lebender Organismen vorgestellt sowie klinische Bezüge bei Störungen desselben aufgezeigt. Über die zahlreichen neuronalen und neuroendokrinen Verbindungen integriert der SCN zeitliche Informationen der Umwelt einerseits und die endogenen biologischen Rhythmen neurohormoneller Achsen – (Hypothalamus-Hypophyse-Nebennieren-Achse (HPA-Achse), Hypothalamus-Hypophyse-Gonaden-Achse (HPG-Achse), thyreotroper Regelkreis etc. – andererseits. Über diese und weitere komplexe Wechselwirkungspfade reguliert SCN das Neurovegetativum sowie Funktionen des Metabolismus, des Immunsystems und des Verhaltens. Klinische relevante Ergebnisse für osteopathische Behandlungen werden diskutiert.
Schlüsselwörter
Umweltreiz, zirkadianer Rhythmus, Hypothalamus-Hypophyse-Nebennieren-Achse, Hypothalamus-Hypophyse-Gonaden-Achse, neurohormonelle Achse, Hypophysen-Schilddrüsen-Regelkreis, metabolische Regulation, autonomes Nervensystem, Neurvegetativum
Abstract
This article elucidates the role of the suprachiasmatic nucleus (SCN) in the circadian regulation of the intrinsic temporal program of living organisms and depicts some clinical aspects of its misalignment. Due to its numerous neuronal and neuroendocrine connections, the SCN integrates temporal information of the environment on the one hand and the endogenous biological rhythms of neurohormonal axes – hypothalamic-pituitary-adrenal axis (HPA-axis), hypothalamic-pituitary-gonadal axis (HPG-axis), thyrotropic feedback control etc. – on the other hand.
Through these and other complex interaction pathways SCN regulates the neurovegetative system as well as functions of metabolism, immune system and behavior. Clinical aspects relevant for osteopathic treatments are discussed.
Keywords
Environmental stimulus, circadian rhythm, hypothalamic-pituitary-adrenal axis, hypothalamic-pituitary gonadal axis, neurohormonal axis, metabolic regulation,
autonomic nervous system, neurovegetative system
Der suprachiasmatische Nukleus (SCN)
Das Leben auf der Erde hat sich im Kontext rhythmischer Umweltreize entwickelt. Die zeitliche Organisation im Verhalten (Nahrungsaufnahme, Schlaf, Aktivität) und in der Physiologie ist allen Organismen gemeinsam und reflektiert die Rhythmik der zyklischen Rotationsbewegung von Sonne, Mond und Erde. Entsprechend der räumlichen Orientierung, die einer inneren Abbildung der Außenwelt bedarf, ist für eine sinnvolle Orientierung im zeitlichen Raum eines Tages, Monats und Jahres eine innere Repräsentation dieser Zeiträume erforderlich. Die zeitliche Koordination unterliegt der Steuerung durch ein endogenes Zeitprogramm und setzt einen vorhersagbaren und repetitiven Rhythmus in der Phylogenese voraus (Dumbell et al. 2016).
Dieses endogene Zeitprogramm findet bei Säugetieren ihr morphologisches Korrelat im suprachiasmatischen Nukleus (SCN) des Hypothalamus. Diese paarig angelegte Neuronengruppe von (beim Menschen) etwa 20.000 dicht gepackten Nervenzellen im vorderen Hypothalamus reguliert als sogenannter zentraler zirkadianer Schrittmacher oder „master-clock“ die gesamte innere Rhythmik des Organismus. Bei Säugern ist die innere Rhythmik mittels des SCN hierarchisch organisiert, indem dieser die peripheren Oszillatoren in allen anderen Geweben wie auch unser Zeitgefühl durch endokrine und neurovegetative Signale reguliert und synchronisiert (Dibner et al. 2010).
Funktion des Ncl. suprachiasmaticus
Allgemeine Funktion des Nucleus suprachiasmaticus
zirkadianer Rhythmus mittels Hell-Dunkel-Wechsel über Retina-hypothalamische Projektionen (→ Corpus pineale)
- Wachen/Schlafen.
- Zirkadian-rhythmisch gesteuerte Aktivität des Endokriniums, Neurovegetativums, Verhaltens (Nahrungsaufnahme, Schlaf, Aktivität), Stoffwechsels und Immunsystems, Körpertemperatur, Blutdruck, etc.
Die Suche nach der Uhr
Die Möglichkeit, im Tierversuch gezielte Läsionen an verschiedenen Gehirnstrukturen zu setzen, führte zur genaueren Lokalisierung des endogenen Schrittmachers in Säugern. Curtis Richter, der zur standardisierten Untersuchung spontaner Aktivitätsphase kleiner Nager im Labor erstmalig das uns umgangssprachlich wohl bekanntes Hamsterrad etablierte, stellte nach zahlreichen akribischen Experimenten in den 50 und 60er Jahren fest, dass Ratten nach Läsionen im rostralen Bereich des Hypothalamus ihr rhythmisches Verhalten verloren (Richter 1967). Moore und Eichler vermuteten eine enge anatomisch-funktionelle Beziehung zum visuellen System und identifizierten 1972 mit nuklearmedizinischer Tracermethode eine Projektion von Nervenfasern, die vom N. opticus zum Hypothalamus führte (Moore et al. 1972).
Zur gleichen Zeit erreichten Stephan und Zucker durch experimentelle Läsionen der SCN-Region der Versuchstiere nicht nur den Verlust des rhythmischen Verhaltens der Nahrungsaufnahme und des Schlaf- und Wach-Zyklus. Auch der Ovulationszyklus und rhythmische Sekretion von Corticosteron (wichtigstes Corticosteroid der Nager) waren bei den ansonsten völlig gesunden Tieren gestört (Stephan u. Zucker 1972).
In elektrophysiologischen Untersuchungen mit isoliertem SCN-Gewebe konnte eine synchrone rhythmische elektrische Aktivität der Zellen von ungefähr 24 Stunden Phasenlänge demonstriert werden (Inouye et al. 1979). Explantations- und Transplantationsversuche bestätigten, dass der essenzielle Mechanismus der biologischen Uhren auf zellulärer Ebene seinen Ausdruck findet. Die rhythmische Spontanaktivität der SCN-Neurone in vitro und ihre metabolische Aktivität, wie sie an der Vasopressinsekretion und Aufnahme von radioaktiv markierter 2-Desoxyglucose beobachtet wurde, lieferten weitere Anhaltspunkte für die zentrale Rolle des SCN (Schwartz et al. 1980).
Die mehr oder weniger zufällige Entdeckung von zwei Hamstern in einer Versuchstierpopulation, welche bei konstanter Dunkelheit einen freilaufenden spontanen Schlaf-Aktivitäts-Rhythmus von 22 Stunden zeigten (im Unterschied zu einem circa dianen, also etwa einen Tag lang dauernden Rhythmus von 24,1 Stunden, wie bei Hamstern des wissenschaftlichen Labors üblich) ermöglichte eine weitere Klärung der Schrittmacherfunktion des SCN. Den Biologen Ralph und Menaker gelang es, mit fetalen SCN-Transplantaten der Tiere mit 22 Stunden Tageslänge diesen „schnelleren“ endogenen Schlaf-Wach-Rhythmus in den „langsameren“ Tieren zu erzeugen. Der biologische Rhythmus der arrhythmischen, weil zuvor SCN abladierten Nager war wiederhergestellt und wies die zirkadianen Eigenschaften des Spenders auf Ralph u. Menaker 1988). Die zentrale Schrittmacherfunktion des SCN, der das endogene Zeitprogramm reguliert, konnte damit geklärt werden.
Der Weg des Lichtes zum SCN
Die Synchronisation der inneren Uhr mit den zeitlichen Hinweisen der Umwelt ist keine passive Reaktion, sondern ein komplexer Anpassungsprozess (sog. „entrainment“). Diese zeitlich-organisatorische Anpassung bietet den Organismen evolutionsphysiologisch den Vorteil der Antizipation von Umweltbedingungen und damit deren optimale Nutzung.
Der Anpassungsprozess ist von den Eigenschaften des endogenen Schrittmachers und des äußeren Stimulus abhängig. Fehlt die zeitliche Information von außen, wie bei den in konstanter Dunkelheit gehaltenen Hamstern von Ralph und Menaker, führt das zur Manifestation der freilaufenden Periodik des endogenen Oszillators (im Fall „schneller“ Hamster waren es 22 Stunden lange „Tage“).
Der äußere, „entrainment“ generierende Stimulus wird als Zeitgeber bezeichnet. Grundsätzlich können photische (Licht) und nicht-photische Zeitgeber (z. B. Temperaturschwankungen, sozialer Kontakt, Nahrungsaufnahme) unterschieden werden. Bei den meisten lebenden Organismen wird der Zeitgeber durch ein stabiles Umweltsignal der Tageszeit, den Hell-Dunkel-Wechsel, repräsentiert. So stellt sich täglich beispielsweise ab etwa 4 Uhr morgens der menschliche Organismus auf den Beginn des Tages ein. Das Tageslicht triggert dabei eine ganze Kaskade physiologischer Veränderungen.
Die Fähigkeit eines Zeitgebers, ein biologisches System zirkadian anzupassen, setzt voraus, dass die Information über die externe Zeit des Tages, Monats und Jahres den endogenen Oszillator erreicht. Für die meisten lebenden Organismen stellt das (Sonnen-)Licht den wichtigsten Zeitgeber dar. Eine enge anatomische Beziehung zum visuellen System liegt also nahe. Der histologische Aufbau des Auges war bereits seit mehr als einem Jahrhundert bestens untersucht, und neue anatomische Erkenntnisse waren nicht zu erwarten, als Chronobiologen Mitte der 1990-er Jahre zunehmend mehr Hinweise auf ein weiteres photosensitives System im Auge (neben Zapfen und Stäbchen) lieferten. Im Tiermodell (Maus) konnten sie zeigen, dass visuell blinde Tiere, die degenerierte, funktionsunfähige Zapfen und Stäbchen besaßen, weiterhin adäquate zirkadiane Antworten auf Lichtreize präsentierten, sie litten also nicht unter zirkadianer „Blindheit”. Beim Verlust des gesamten Auges und somit auch der Lichtrezeptoren für das zirkadiane System erfolgte keine zirkadiane Antwort auf Lichtimpulse mehr (Lucas et al. 1999). Auch Lichtinterventionsstudien am Menschen zeigten, dass blinde Probanden mit äußerlich intakten Augen mit Hilfe von hellem Licht an den äußeren Tag synchronisiert werden können (Czeisler et al. 1995).
Die für das zirkadiane System relevante Lichtrezeption findet zwar an der Retina statt, nicht jedoch durch Stäbchen und Zapfen wie traditionell angenommen. Der Weg des Lichts führt vielmehr über spezialisierte, direkt lichtempfindliche Netzhautzellen (sog. intrinsisch photosensitive retinale Ganglienzellen, ipRGCs), die etwa 1% der gesamten Ganglienzellpopulation der Netzhaut ausmachen und insbesondere im inferior-nasalen/medialen Bereich der Retina lokalisiert sind (Foster et al. 2002). Sie führen mit ihren ableitenden Nervenaxonen mittels des Tractus retinohypothalamicus (RHT) zum SCN. Rein morphologisch leitet sich der RHT von Axonkolateralen der Axone der Nn. optici ab, die etwa am 4. postnatalen Tag aus dem Chiasma opticum in den ventralen Teil des SCN einwachsen Stephan u. Zucker 1972). Die Lichtdetektion der direkt lichtempfindlichen Ganglienzellen der Netzhaut erfolgt mittels des Photopigments Melanopsin, welches phylogenetisch viel älter ist als die Photopigmente der Zapfen und Stäbchen (Provencio et al. 2002; Sekaran et al. 2003).
Die Signaltransduktionskaskade, die zur Auslösung des zellulären Aktionspotenzials führt, erfolgt melanopsingetriggert, nachdem das photonabsorbierende Chromophor-Molekül 11-cis-retinaldehyd in All-trans-Zustand umgewandelt wird. Zunächst in den retinalen Ganglienzellen des Nagers (die zumeist nachtaktiv sind) identifiziert, konnte Melanopsin auch bei (tagaktiven) Makaken isoliert werden, deren visuelles System dem humanen ähnelt (Dacey et al. 2005). Das Absorptionsmaximum von Melanopsin liegt bei 480 nm, was dem Blauanteil des Lichtspektrums entspricht. Die melanopsinproduzierenden Ganglienzellen können damit das (besonders blauanteilreiche) Licht der Dämmerung identifizieren und so den Übergang zwischen Tag und Nacht aufgrund der veränderten spektralen Zusammensetzung des Lichtes wahrnehmen (Foster 2005).
Im Unterschied zum visuellen System, welches eine präzise Information über räumliche und zeitliche Auflösung eines Lichtsignales liefert („image forming retinal pathway“), beinhaltet die Projektion des zirkadianen Systems Informationen über Intensität und Spektrum des empfangenen Lichtes („non-image forming retinal pathway“). Diese beiden Systeme arbeiten nicht vollständig getrennt voneinander, denn zum Teil gelangen retinale Lichtinformationen auch vom Corpus geniculatum laterale (einer Hirnstruktur, welche Informationen des „image forming retinal pathway“ an den visuellen Kortex weiterleitet) mittels des Tractus geniculohypothalamicus zum SCN, was eine Interaktion nahelegt (Foster 2005).
Vom SCN wird die zirkadiane Information nach Umschaltung im paraventrikulären Nukleus und suprazervikalen Ganglion zu weiteren Hirnstrukturen geleitet, unter anderem zum Corpus pineale, einer hormonproduzierenden Drüse, auch Zirbeldrüse oder Epiphyse genannt. Die Rolle dieses Organs ist, abgesehen von der Melatoninproduktion, noch nicht eindeutig geklärt; eine Kontrollfunktion jahresrhythmischer Prozesse, wie Reproduktion und Winterschlaf, wird angenommen (Pevet 2000).
Bei Reptilien und manchen Vogelarten ist das Epiphysengewebe direkt lichtempfindlich (daher auch die Bezeichnung „drittes Auge“) und stellt den dominanten rhythmischen Oszillator dar, der die Tagesperiodik kontrolliert (Gaston et al. 1968; Underwood et al. (1990).
Interne Synchronisation und parakrine Mechanismen innerhalb des SCN
Unter In-vivo-Bedingungen integriert der SCN exogene und endogene Signale, vor allem den Hell-Dunkel-Wechsel, und ermöglicht so dem Organismus, sich optimal auf die Umweltbedingungen vorzubereiten. Die Besonderheit der Zellen des SCN besteht darin, dass sie auch ohne äußere Einflüsse ihre rhythmische Aktivität aufrechterhalten. So wurden sowohl im explantierten SCN-Gewebe als auch nach Isolation einzelner SCN-Zellen in vitro autonome zirkadiane Oszillationen neuronaler Aktivität nachgewiesen (Welsh et al. 1995). Allerdings zeigt der Vergleich zwischen SCN-Gewebekulturen und Kulturen einzelner Zellen, dass die Abweichungen zirkadianer Perioden der Zellen in den Hirnschnitten geringer sind (Herzog et al. 2004).
Die einzelnen Oszillatoren mit durchaus unterschiedlichen endogenen Perioden stabilisieren und synchronisieren sich gegenseitig. Je höher der Organisationsgrad der Zellen, desto stabiler und präziser die zirkadiane Oszillation. Eine kohärente Schrittmacherfunktion scheint also auf gegenseitige intra- und interzelluläre Prozesse angewiesen zu sein. Die Ausbildung von derartigen synchronisierenden neuronalen Schaltkreisen bzw. neuronalem Netzwerk innerhalb des SCN wird durch verschiedene Mechanismen erreicht wie Zellverbindungen sowie humorale und parakrine Faktoren.
Aus Experimenten an explantierten und isolierten SCN-Zellen konnte geschlussfolgert werden, dass In-vivo-Zellverbindungen vom Gap-junction-Typ einen wesentlichen Anteil an der Synchronisation vermitteln (Long et al. 2005). Die Neurotransmitter Glutamat und γ-Aminobuttersäure (GABA) sind für lokale intrinsische Signalübertragung verantwortlich und im nahezu gesamten SCN verbreitet (Albus et al. 2005). Mittels Glutamat wird auch die Lichtinformation vom retinohypothalamischen Trakt im ventromedialen SCN-Bereich übertragen, und GABAerge Neurone projizieren vom SCN in andere Regionen des Hypothalamus, wie z.B. in Teile des paraventrikulären Nukleus.
Neben GABA sind auch einige Neuropeptide wie das in der ventrolateralen Randzone exprimierte vasoaktive intestinale Peptid (VIP) und das im dorsomedialen Kern produzierte Arginin-Vasopressin (AVP) an der Informationsverarbeitung innerhalb des SCN beteiligt und darüber hinaus in die Regulation der Hormonsekretionssynchronisation von peripher im Gewebe gelegenen Oszillatoren involviert (Hastings et al. 2007).
Durch Kombination von pharmakologischen und genetischen Manipulationen konnte im Tiermodell gezeigt werden, dass der zirkadiane Rhythmus auf der zellulären Ebene durch eine hierarchisch angeordnete parakrin neuropeptiderge Signalübertragung mitbedingt ist. Dabei spielt das VIP eine prominente Rolle, unterstützt von AVP und „gastrin releasing peptide“ (GRP) (Maywood et al. 2006).
Afferente und efferente Bahnen des SCN
Der SCN besitzt eine Vielzahl afferenter und efferenter Verbindungen. Der oben erwähnte RHT (retinohypothalamischer Trakt) projiziert hauptsächlich in den ventrolateralen Bereich des SCN, setzt neben Glutamat auch „pituitary adenylate cyclase activating peptide“ (PACAP) und Substanz P (SP) als Neurotransmitter frei und übermittelt somit die Information über die Umgebungshelligkeit zur Synchronisation mit dem Hell-Dunkel-Wechsel. Nicht-photische Informationen erreichen den SCN mittels indirekter Innervationen über die Raphekerne und das „intergeniculate leaflet“ (IGL) und tragen so zur Synchronisation der SCN-Neurone bei (Hastings et al. 1996). Das Kerngebiet des SCN erhält außerdem Serotoninfasern aus dem Nucleus raphe dorsalis und dem Nucleus raphe magnus des Hirnstamms.
Neben den erwähnten afferenten Fasern projizieren noch eine Reihe weiterer Hirnregionen zum SCN, z.B. Teile des Thalamus, des limbischen Systems und des Hypothalamus (Madeira et al. 2004).
Über eine Vielzahl direkter und indirekter efferenter Projektionen des SCN werden zahlreiche Gehirnregionen mit zirkadianen Steuersignalen versorgt (Abb. 1). So konnten einige Verbindungen vor allem in weite Teile des Hypothalamus sowie die Projektion zur Epiphyse näher charakterisiert werden, welche an der Steuerung komplexer neuroendokriner Funktionen beteiligt sind (Abrahamson u. Moore 2001). Im Folgenden werden einige Beispiele aufgeführt:
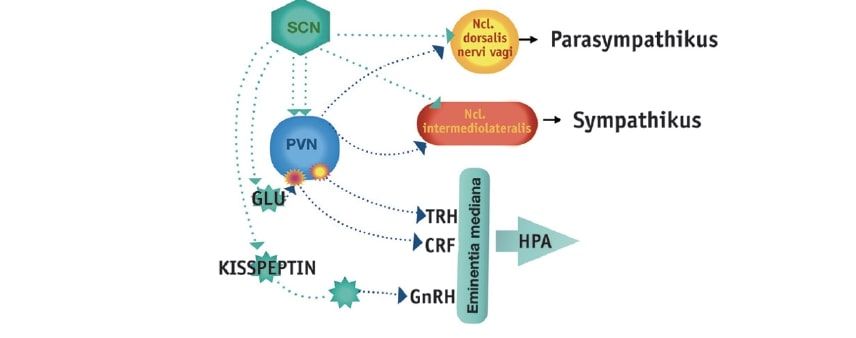
Abb. 1: Rhythmusgenerierende Neuronen des Nucleus suprachiasmaticus (SCN) projizieren direkt oder mittels Interneurone zum paraventrikulären Nukleus (PVN) des Hypothalamus. Nach Umschaltung im PVN erreichen die Projektionen die Steuerinstanzen der hormonellen Achsen (TRH=Thyrotropin releasing hormone, CRF =Corticotropin releasing factor, GnRH=Gonadotropin releasing hormone) und des autonomen Nervensystems.
Hypothalamus-Hypophyse-Nebennieren-Achse („hypothalamic-pituitary-adrenal axis“; HPA-Achse)
„Corticotropin releasing factor“ (CRF) (auch „Corticotropin releasing hormone“ oder Corticoliberin) produzierende Neurone des Nucleus paraventricularis (PVN) des Hypothalamus werden vom SCN durch direkte Projektionen oder mittels Interneuronen innerviert, was die tagesrhythmische Freisetzung des CRF bedingt. Im tagaktiven Zustand fördern die Arginin-Vasopressin (AVP) enthaltenden Axone aus dem SCN die Produktion des CRF und aktivieren dadurch die HPA-Achse (Ulrich-Lai et al. 2006).
Die tagesrhythmische Kontrolle der Cortisolsekretion über den autonomen SCN-adrenalen Weg wird durch die sympathische Innervation der Nebennieren gesteuert (N. splanchnicus). So konnte im Tierversuch demonstriert werden, dass direkte Lichtinformation mit einer erhöhten Ausschüttung von Cortisol einhergehen. Dies geschieht unabhängig von der Aktivierung der HPA-Achse (Abb. 2) (Chung et al. 2011)

Abb. 2: Tagesrhythmische Regulation der Cortisolsekretion und Biosynthese (in Anlehnung an Chung et al. 2011). Schwankungen des zirkulierenden Cortisol-Levels werden durch mehrere Regulationsmechanismen erreicht:
– Modulation der HPA-Achsenaktivität durch den SCN,
– Innervation des N. splanchnicus der Nebennierenrinde,
Zudem konnte gezeigt werden, dass bei Ratten die tagesrhythmische Corticosteronfreisetzung (das wichtigste Steroidhormon der Nager) durch Modulation der Sensitivität der Nebennieren gegenüber ACTH beeinflusst wird (Ulrich-Lai et al. 2006).
Die Regulation der Sensitivität der Nebenniere gegenüber einer ACTH-Stimulation erfolgt wiederum über die SCN-kontrollierte sympathische Nerveninnervation (N. splanchnicus) (Ulrich-Lai et al. 2006).
Das molekulare Uhrwerk der cortisolproduzierenden Zellen der Nebennierenrinde kann ebenfalls durch die Aktivierung des autonomen SCN-adrenalen Weges beeinflusst werden (Oster et al. 2006; Ishida et al. 2005). So unterliegt die tagesrhythmische Freisetzung des Cortisols durch Modulation der HPA-Achse und durch die sympathische splanchnische Innervation der Nebenniere der direkten SCN-Kontrolle. Allerdings spielt auch das lokale Uhrwerk der Nebenniere selbst eine wichtige Rolle, z.B. bei der Aufrechterhaltung des Cortisolrhythmus durch die Kontrolle der Kapazität und Sensitivität der adrenalen Cortisolsekretion und Biosynthese (Chung et al. 2011).
Klinische Revelanz
Eine dysregulierte Cortisolsekretion kann zu zahlreichen Erkrankungen führen und ist unter anderem mit der Entstehung von Alzheimer-Demenz und metabolischem Syndrom assoziiert (Carroll et al. 2008; Ferrari et al. 2001; Pasquali et al. 2006; Bao et al. 2008). Eine Entkopplung von der Feinabstimmung zwischen ACTH- und Cortisolsekretion durch endogene oder exogene Einflüsse wurde in einigen Studien mit dem Auftreten von chronischem Müdigkeitssyndrom, posttraumatischer Belastungsstörung, Alkoholismus sowie Sepsis in Zusammenhang gebracht (De Kloet et al. 2006). Insbesondere können verschiedene potenziell störende Einflüsse wie Schicht-/Nachtarbeit, Jetlag, Schlafentzug oder nächtliche Nahrungsaufnahme sowohl bei kurzzeitigem als auch bei chronischem Bestehen schwerwiegende Dysregulationen der zirkadianen Anpassung zur Folge haben und die Entwicklung von diversen Pathologien nach sich ziehen (Garaulet u. Madrid 2009; Filipski et al. 2004).
Hypothalamus-Hypophyse-Gonaden-Achse („hypothalamic-pituitary-gonadal axis”, HPG-Achse)
Der SCN beeinflusst die „Gonadotropin releasing hormone“ (GnRH) produzierenden Neurone im Nucleus praeopticus. Außerdem interagieren zirkadiane Rhythmen mit peripheren serotoninergen Systemen zur Regulation der Laktation (Costa-e-Sousa u. Hollenberg 2012). Der neurale Oszillator im SCN ist wesentlich für die Taktung des präovulären Anstiegs des luteinisierenden Hormons (LH) (Kriegsfeld u. Silver 2006; De la Iglesia u. Schwartz 2006). Als ein Korrelat für die Rückkopplungsregulation zwischen der Sekretion von GnRH und SCN konnten im Tierversuch postsynaptische Fasern von GnRH produzierenden Zellen im SCN indentifiziert werden (Van der Beek et al. 1997). Läsionen des SCN führen zu einer gestörten Steuerung der LH-Sekretion, der Ovulation und des Zyklus in weiblichen Ratten (Wiegant u. Terasawa 1982).
Klinische Relevanz
Auch bei der Regulation der HPG-Achse wird deutlich, dass Prozesse wie die Ovulation keine reinen linearen Top-Down-Prozess darstellen, sondern durch multioszilläre Systeme getaktet werden und von einem normalen Funktionieren der Synchronisation ihrer gekoppelten Bestandteile abhängig sind (Sellix u. Menaker 2010).
Ebenso ist klinisch relevant, dass Störungen der zirkadianen Taktung der HPG-Achse, z.B. bei Nacht-/Schichtarbeit oder Interkontinentalflügen, an der Entstehung von Infertilität, Menstruationsstörungen, menstruellen Schmerzen, einer veränderten Dauer der Follikelphase, veränderten FSH-Spiegeln und Follikelphasen, von niedrigen Geburtsgewichten sowie einer erhöhten Inzidenz von Fehlgeburten beteiligt sind (Abb. 3) (Mahoney 2010; Shechter u. Boivin 2010).

Abb. 3: Hypothese zu einer gestörten Synchronisation der HPG-Achse in Anlehnung an Sellix et al. (2010). In jeder Komponente der HPG-Achse befinden sich zirkadiane Oszillatoren. Eine gestörte Taktung der physiologischen Prozesse ist dabei von desynchronisierten Beziehungsgefügen zwischen dem SCN, Neuronen des GnRH, Zellen der Hypophyse und Ovarialzellen abhängig. Eine gestörte Synchronisation in der HPG-Achse kann durch eine Verminderung der Amplitude oder der Stärke der zirkadianen Uhren in Zielorganen oder eine Veränderung der Amplitude oder der zeitlichen Strukturen zentralen oder peripheren Ursprungs zu einer Desynchronisation in der HPG-Achse führen. Diese können wiederum Störungen der Fortpflanzungsorgane zur Folge haben und eine reduzierte Fertilität verstärken oder sogar auslösen (Abkürzungen: GnRH „gonadotropin releasing hormone“; LH luteinisierendes Hormon)
Thyreotroper Regelkreis (Hypophysen-Schilddrüsen-Regelkreis, „hypothalamic-pituitary-thyroid axis”, HPT-Achse)
Der anteriore Anteil des Hypothalamus beeinflusst zirkadiane Variationen des zirkulierenden Thyreotropins (TSH) und damit die tagesrhythmischen Schwankungen der peripheren Schilddrüsenhormone. Dies geschieht mittels der Projektion der SCN-Neurone in die parvozellulären Neurone des Nucleus paraventricularis Kalsbeek et al. 2000; Costa-e-Sousa u. Hollenberg 2012). Allerdings beeinflussen Schilddrüsenhormone nicht die zirkadianen Uhrengene, sodass der zirkadiane Rhythmus unabhängig von negativen Feedbackmechanismen, wie die inhibitorische Wirkung von freiem T4 auf die Sekretion des Steuerhormons TSH, reagiert Caria et al. 2009).
Möglicherweise steht die zirkadiane Regulation der HPT-Achse unter der Kontrolle neuronaler Leitbahnen, unabhängig von negativen Feedbackmechanismen der Schilddrüsenhormone. Es kann allerdings dennoch die Möglichkeit nicht ausgeschlossen werden, dass nicht-genomische Prozesse von Schilddrüsenhormonen die Erregbarkeit von Neuronen kontrollieren, welche die hypothalamische Schaltung bilden und die Rhythmik von TRH-Ausschüttung determinieren Costa-e-Sousa u. Hollenberg 2012).
Klinische Relevanz
Klinisch beeinflusst die Zerstörung des SCN die rhythmische Fluktuation zirkulierender Kortikosteroide, die wiederum einen inhibitorischen Einfluss auf die TRH-Ausschüttung ausüben (Alkemade et al. 2005). Dementsprechend wirkt die HPA-Achse inhibierend auf die HPT-Achse.
Neurovegetativum (ANS)
Mittels SCN-Projektionen zum Nucleus dorsalis nervi vagi wird die parasympathische Aktivität tagesrhythmisch reguliert. Mittels Verbindungen zu Interneuronen im Thoraxsegment werden sympathische präganglionäre Neurone beeinflusst. Zudem wird das Neurovegetativum über den SCN durch die Innervation der präautonomen parvozellulären Neurone des Nucleus paraventricularis beeinflusst. Axone, die dorsal und kaudal im Nucleus paraventricularis lokalisiert sind, führen entweder direkt – oder mittels katecholaminerger Neurone der Formatio reticularis – zum Nucleus intermediolateralis des thorakalen Rückenmarkabschnittes und können so die sympathischen präganglionären Neurone, z.B. im Ganglion cervicale superius, beeinflussen.
Lichtstimulation erhöht unmittelbar das Adrenalinniveau im Plasma (Ishida et al. 2005). Wie bereits ausgeführt, wird der zirkadiane Einfluss des SCN auf die HPA-Achse über die neurovegetative Innervation der Nebennieren (N. splanchnicus) vermittelt. So kommt es mittels Lichtstimulation zu einer SCN-abhängigen schnellen Induktion einer Per1-Expression in der Nebenniere (Ishida et al. 2005).
Epiphyse (Zirbeldrüse, Corpus pineale, Pinealorgan)
Die zirkadiane Kontrolle der Epiphyse über efferente Bahnen des SCN ist vergleichsweise gut untersucht. Die endogene, im SCN generierte Oszillation wird durch die RHT-vermittelten Informationen über Umgebungshelligkeit moduliert und zum paraventrikulären Nucleus (PVN) des Hypothalamus projiziert. Am Tag erfolgt eine GABAerge Inhibition der PVN-Neurone, nachts hingegen eine glutamatvermittelte Exzitation derselben (Perreau-Lenz et al. 2003). Vom PVN wird das Signal über den Nucleus intermediolateralis (IML) des Rückenmarks und das Ganglion cervicale superius (SCG) zur Epiphyse übertragen. Synthese und Ausschüttung des Epiphysenhormons Melatonin erfolgen nachts mit einer hohen, tagsüber mit einer niedrigen Rate.
In In-vitro-Untersuchungen an Hirnschnitten wurden im SCN Melatoninrezeptoren identifiziert (Vanecek et al. 1987), was eine direkte Rückkopplung des freigesetzten Hormons auf das zirkadiane System und konsekutiv die Verschiebung von Schlaf-Wach-Phasen ermöglicht (Lewy et al. 1980). Das nächtliche Melatoninsignal stellt die Uhrzeitinformation für alle Zellen und Organe bereit und ist laut Blask (2009) der stabilste und zuverlässigste periphere Biomarker der Zeitmessung der zentralen biologischen Uhr (Abb. 4).

Abb. 4: Zirkadiane Kontrolle der Epiphyse: Die neuronale Leitbahn beinhaltet den paraventrikulären Nukleus (PVN), Nucleus intermediolateralis (IML), das Ganglion cervicale superius (GCS) sowie die Zirbeldrüse
Die Schlafhomöostase ist vom Schlafdruck und vom zirkadianen Rhythmus abhängig. Der Nucleus praeopticus ventrolateralis (VLPO) des vorderen Hypothalamus ist ein Schlüsselfaktor für das Ein- und Durchschlafen, während der lateral-posteriore Teil des Hypothalamus für das Wachverhalten mitverantwortlich ist (Saito et al. 2018).
Ein eng umschriebener Bereich des lateral-posterioren Teils des Hypothalamus beinhaltet spezialisierte, das Neuropeptid Orexin synthetisierende Neurone, dem neben seiner wesentlichen Bedeutung für die Schlaf-Wach-Regulation auch eine wichtige Rolle bei der Energiehomöostase und der Appetitbildung zugeschrieben wird.
Die orexinergen Bahnen des der lateral-posterioren Teils des Hypothalamus projizieren in weite Teile des Gehirns, u.a. in den SCN, wobei die meisten Fasern im SCN-nahen Bereich enden (Sakurai 2007). Auch im SCN selbst konnten sowohl vereinzelt orexinerge Fasern als auch eine geringfügige Orexinsekretion sowie Orexinrezeptoren identifiziert werden (Mondal et al. 1999). Die letzteren wurden insbesondere auf AVP (Arginin-Vasopressin) und VIP (vasointestinales Polypeptid) exprimierenden Zellen nachgewiesen (Bäckberg et al. 2002). Die AVP- und VIP-exprimierenden Bahnen wiederum projizieren zu den orexinergen Neuronen im lateral-posterioren Teil des Hypothalamus (Abrahamson u. Moore 2001), was neben einem engen morphologischen Bezug auch eine funktionelle Verknüpfung zwischen dem lateral-posterioren Teil des Hypothalamus und dem zirkadianen Netzwerk des SCN nahelegt. Diese findet in dem tagesrhythmisch schwankenden Orexinspiegel im Liquor cerebrospinalis seinen Ausdruck (Grady et al. 2006).
Praktische Relevanz hat auch der Verdacht, dass das morgendliche Tragen von Sonnenbrillen, insbesondere mit orange-farbenen Gläsern, die das Blaulicht blocken, die Resynchronisierung der biologischen Uhr durch das Sonnenlicht behindern (Sasseville et al. 2006).
Uhren überall: Zirkadianes Uhrennetzwerk des Organismus
Wie bei den Ausführungen zur zirkadianen Regulation der neurohormonellen Achsen dargelegt, kann der SCN zwar als zentraler Schrittmacher angesehen werden, lokale oszillatorische Systeme auf Organ- bzw. Gewebeebene spielen jedoch bei der zirkadianen Regulation ebenfalls eine wichtige Rolle. Experimentell wurden diese lokal wirksamen zirkadianen Mechanismen vielfach untersucht. Aber auch ohne externe Lichtinformationen und soziale Einflüsse bleiben zirkadiane Rhythmen bestehen (Czeisler u. Klerman 1999).
Im Tierversuch konnte gezeigt werden, dass zirkadiane Uhren praktisch in jeder Zelle und jedem Organgewebe vorkommen und unter normalen Bedingungen durch den SCN synchronisiert werden (Buijs u. Kalsbeek 2001; Balsalobre 2002).
Im Falle einer Zeitverschiebung und daraus resultierender Desynchronisation zwischen der inneren und äußeren Zeitstruktur stellt sich der zentrale Schrittmacher vergleichsweise schnell um (Yamazaki al. 2000). Die peripheren Uhren der inneren Organe jedoch passen sich jeweils mit unterschiedlicher Geschwindigkeit und in unterschiedlichem Ausmaß dem neuen zeitlichen Rahmen an, was zur Entkopplung der einzelnen Rhythmen im zirkadianen Netzwerk des Organismus mit daraus resultierenden Symptomen führt (Hastings et al. 2003).
Ein weiterer Aspekt der Komplexität des endogenen Zeitprogramms liegt im unterschiedlichen Antwortverhalten zentraler und peripherer Uhren bezüglich der äußeren Zeitgeberstimuli. So reagiert SCN auf Licht, die innere Uhr der Leber dagegen vor allem auf Nahrungsaufnahme: Sie unterliegt, wie andere periphere Oszillatoren SCN-gesteuert nur indirekt dem Lichteinfluss (Damiola et al. 2000; Stokkan et al. 2001).
Periphere innere Uhren existieren seit über 600 Millionen Jahren. Bereits Fruchtfliegen haben diese. Jede Zelle und jedes Organ besitzt eigene Uhren, z.B. weisen 3–20% der Gene einen rhythmischen Ausdruck auf. 12 unterschiedliche Uhren-Gene und etwa 20 modulierende Gene konnten bisher beim Menschen nachgewiesen werden.
Auf der Suche nach der genetischen Grundlage der biologischen Uhren wurde zunächst ein Uhren-Gen der Fruchtfliege Drosophila gefunden. Wurde der molekulare Mechanismus des intrinsischen Oszillators durch einen gezielten Eingriff ins Erbgut der Fliege gestört, präsentierte sie arrythmische Aktivitätsphasen, oder diese fehlten völlig (Konopka u. Benzer 1971). In den 1990-er Jahren wurde das erste Uhren-Gen in Säugern (Maus) identifiziert. Es folgten zahlreiche weitere Gene und Genprodukte, deren tagesrhythmische Expression auf Zeitgeberstimuli reagiert (Honma et al. 2004; Shearman et al. 2000).
Gemäß des derzeitigen genetischen Modells der inneren Uhr der Säugetiere bilden ineinander verzahnte transkriptonale-translationale Feedbackschleifen (TTL) die Grundlage für die zirkadiane Oszillation auf zellulärer Ebene (Brown et al. 2012).
Kurz zusammengefasst wird während des Tages der Transkriptionsfaktor CLOCK („circadian locomotor output cycles caput“) oder NPAS2 („neuronal PAS domain-containing protein 2“) mit BMAL1 („brain and muscle aryl hydrocarbon receptor nuclear translocator-like 1“) an E-box- („enhancer box“) Promotoren gebunden, um die Entfaltung von Period (Per1–3) und Cryptochrome (Cry1/2) und andere zu stimulieren. So kommt es über den Tag zu einem Anstieg von PER/CRY-Proteinkomplexen im Zytoplasma, die sich später in den Zellkern verschieben, wo sie die Aktivität von CLOCK-BMAL1-Komplexen (oder NPAS2–BMAL1-Komplexen) inhibieren. Dies führt während der Nacht zu einer Abschaltung der Per/Cry-Transkription. Zum nächsten Morgen hin mit zunehmendem Abbau der im Zellkern befindlichen PER/CRY-Komplexe beginnt ein neuer Zyklus mit einem Anstieg von PER/CRY-Proteinkomplexen im Zytoplasma (Dumbell u. Matveeva 2016).
Neben den Sehzellen werden explizit zirkadiane Gene (PER2, 3 oder CLOCK) u.a. mit der Regulation von Zellalterung und unkontrolliertem Zellwachstum in Verbindung gebracht Fu u. Lee 2003). Beispielsweise kommt es bei einem Defekt des period-Gens zum Verlust des peripheren Rhythmus. Eine molekularbiologische Löschung eines einzigen, den Tagesrhythmus steuernden Gens (PER2) im Tierversuch, lässt die betroffenen Tiere dramatisch schneller altern und sterben als die Vergleichsgruppe von genetisch identischen Ratten mit intakten Rhythmusgenen Fu u. Lee 2003; Lee 2006). Periphere zirkadiane Rhythmen gibt es z.B. im Genausdruck von Leber, Fettgewebe, Muskulatur, Brustdrüse und Herzgewebe (Green et al. 2008).
Diese inneren Uhren stimmen sich aufeinander ab und zeigen beim Menschen einen Zyklus von 24,20 Stunden, gehen aber im Vergleich zum SCN relativ ungenau. Durch den kontinuierlichen Abgleich zellinterner Zeitmessungen und die dadurch mögliche Selbstkorrektur des Gen- und Proteinausdrucks mit äußeren Zeitgebern, insbesondere Lichtinformationen mittels des SCN, aber auch durch soziale Faktoren entsteht eine präzise rhythmische Abstimmung im Organismus (Pittendrigh 1993).
Die partielle Flexibilität des selbsterregten biologischen Oszillators erlaubt einerseits eine harmonische zeitliche Koordination der Physiologie und des Verhaltens eines Organismus mit dessen von außen oder innen bedingten Veränderungen. Andererseits muss dieser mit dem äußeren Tag stabil synchronisiert bleiben, um periodische Vorgänge der Umwelt antizipieren zu können. Jeder beobachtete zirkadiane Rhythmus ist das Produkt endogener und exogener Einflüsse (Abb. 5).

Abb. 5: Synchronisierung zirkadianer Zeitkontrolle im Körper. (Modifiziert in Anlehnung an Hastings et al. 2007). Zirkadiane Koordination innerhalb des Organismus, in welchem der primäre Schrittmacher des SCN, geleitet durch Sonneneinstrahlung von retinalen Afferenzen, gewebebasierten Uhren in den Hauptorgansystemen und durch Wechselbeziehungen aus endokrinen, neurovegetativen, verhaltensbezogenen (ernährungsbezogenen) sowie immunologischen Signalen aufrechterhalten und synchronisiert wird
Klinische Relevanz der Erkenntnisse zum zirkadianen Rhythmus
Chronisch kranke Menschen scheinen häufig Verschiebungen in ihrem zirkadianen Rhythmus aufzuweisen (Kanikowska et al. 2015; Moore-Ede et al. 1983; Luce 1970). Beispielsweise beeinträchtigen Veränderungen von Schlafzyklen das Immunsystem (Bollinger et al. 2010).
Die klinische Manifestation von Verschiebungen des zirkadianen Rhythmus könnte deshalb in der osteopathischen Behandlung, insbesondere bei chronischen Erkrankungen, berücksichtigt werden. Aber auch in der therapeutischen Begleitung von gesunden Personen, beispielsweise Sportlern in Bezug zum Schlaf-Wach-Verhalten, Jetlag bei internationalen Wettkämpfen, zu den Zeiten der Essensaufnahme, der Trainingsabläufe und Bewegungsarten etc. spielen tagesrhythmische Betrachtungen eine große Bedeutung Drust et al. 2005; Hammouda et al. 2013).
So können Unterschiede von zeitabhängigen Höchstleistungen auf interne physiologische Mechanismen und zirkadiane Einflüsse zurückgeführt werden Facer-Childs u. Brandstaetter 2015). Ein beispielsweise durch Reisen hervorgerufener Jetlag, der mehr als 5 Stunden differierende Zeitzonen beträgt, erhöht die Krankheitsanfälligkeit um den Faktor 2–3 Schwellnus et al. 2012).
Viele Personen, insbesondere der späte Chronotyp (sog. Eule-Phänotyp) erfahren täglich sich wiederholende zirkadiane Störungen, die sich auf Leistungsfähigkeit, Gesundheit und Wohlbefinden auswirken können Horne u. Moseley 2011; Roenneberg et al. 2013; Samuels 2009).
Konklusion
Lebende Organismen präsentieren eine endogene Periodik im Verhalten (Schlafen und Wachen, Ruhe und Aktivität, Aufmerksamkeit) und der Physiologie (Körpertemperatur, Hormonausschüttung, Stoffwechselvorgänge etc.). Sie passen sich damit den Veränderungen der Umwelt nicht nur reflektorisch an, sondern antizipieren diese, um sich optimal vorzubereiten. Die Fähigkeit zur Antizipation von Umweltbedingungen und -prozessen stellt einen essenziellen Mechanismus für ein erfolgreiches Fortbestehen eines Lebewesens dar und und führte im Laufe der Evolution zur Entwicklung endogener Zeitprogramme.
Das morphologische Korrelat des endogenen Zeitprogramms stellt bei Säugern der suprachiasmatische Nucleus (SCN) im vorderen Hypothalamus dar. Das intrinsische molekulare Uhrenwerk generiert eine selbsterhaltende Oszillation mit einer Periode von circa einem Tag (zirkadian) und wird durch stabile äußere Stimuli der Umwelt (sog. Zeitgeber) synchronisiert. Den wichtigsten Zeitgeber für lebende Organismen stellt das (Sonnen-)Licht bzw. der Tag-Nacht-Wechsel dar. Der SCN erhält die Information über die Intensität und die spektrale Zusammensetzung des einfallenden Lichtes über spezialisierte Ganglienzellen der Retina und den retinohypothalamischen Trakt (RHT). Die Neuronen des SCN werden untereinander mittels parakriner Mechanismen synchronisiert und leiten zirkadiane Informationen an zentrale und periphere Effektoren weiter. Damit werden durch das zirkadiane Netzwerk im SCN sowohl die äußeren Umweltreize als auch die internen zeitlichen Signale der peripheren Organ- und Gewebeoszillatoren integriert und reguliert.
Insbesondere chronisch kranke Menschen zeigen häufig Verschiebungen in ihren biologischen Rhythmen. Die Berücksichtigung dieser chronobiologischen Verschiebungen stellt in der Behandlung chronischer Erkrankungen einen wichtigen Aspekt dar. Im osteopathischen Kontext geht es hier weniger um palpable rhythmische Erscheinungen, wie in kranialen oder viszeralen Aspekten der Osteopathie spekulativ formuliert. Vielmehr steht hier ein Verständnis polyrhythmischer Phänomene und Wechselwirkungen im Vordergrund. In diesem Sinne sind Symptome proaktive Zeichen, die als Hinweis für eine Verhaltensänderung verstanden werden können. Dementsprechend geht es weniger darum, z.B. Gehirnzentren palpatorisch manipulieren zu wollen, sondern eher darum, den Patienten darin zu unterstützen, chronobiologische Dysfunktionen und Desynchronisation zwischen der inneren und äußeren Zeitstruktur wahrzunehmen, lesen und verstehen zu lernen und gezielt Verhaltensänderungen bzw. Vermeidungsverhalten einzuleiten, um die Homöostase zu verbessern. Wie erkenne ich beispielsweise frühzeitig, am besten noch, bevor chronische Beschwerden sich einstellen, dass meine Stressachse aktiviert wurde, die meine rhythmischen Muster beeinträchtigen, wie z.B. den Schlaf, und wie kann ich hier angemessen reagieren und agieren?
Hier geht es darum, die Eigenverantwortung im Patienten zu unterstützen. Psychoedukation und für das eigene Leben bedeutsame Lernerfahrungen sind dementsprechend wesentliche Aspekte auch osteopathischer Interaktionen. Osteopathische manipulative Palpationen können diese Eigenregulationen unterstützen und das eigene Körperempfinden des Patienten schulen.
Littérature
[1] Abrahamson EE, Moore RY. Suprachiasmatic nucleus in the mouse: retinal innervation, intrinsic organization and efferent projections. Brain Res 2001 916: 172–191
[2] Albus H, Vansteensel MJ, Michel S, Block GD, Meijer JH, 2005. A GABAergic mechanism is necessary for coupling dissociable ventral and dorsal regional oscillators within the circadian clock. Curr Biol 2005; 15: 886–893
[3] Alkemade A, Unmehopa UA, Wiersinga WM, Swaab DF, Fliers E. Glucocorticoids decrease thyrotropin-releasing hormone messenger ribonucleic acid expression in the paraventricular nucleus of the human hypothalamus. J Clin Endocrinol Metab 2005; 90: 323–327
[4] Bäckberg M, Hervieu G, Wilson S, Meister B. Orexin receptor-1 (OX-R1) immunoreactivity in chemically identified neurons of the hypothalamus: focus on orexin targets involved in control of food and water intake. Eur J Neurosc 2002; 15: 315–328
[5] Balsalobre A. Clock genes in mammalian peripheral tissues. Cell Tissue Res 200; 309 (1): 193–9
[6] Bao AM, Meynen G, Swaab DF, The stress system in depression and neurodegeneration: focus on the human hypothalamus, Brain Res. Rev 2008; 57: 531–553
[7] Blask DE. Melatonin, sleep disturbance and cancer risk. Sleep Medicine Reviews. 2009; 13: 257–264
[8] Bollinger T, Bollinger A, Oster H et al. Sleep, immunity, and circadian clocks: a mechanistic model. Gerontology 2010; 56 (6): 574–80
[9] Brown SA, Kowalska E, Dallmann R. (Re)inventing the circadian feedback loop. Dev Cell 2012; 22 (3): 477–87
[10] Buijs RM and A. Kalsbeek. Hypothalamic integration of central and peripheral clocks. Nat Rev Neurosci 2001; 2 (7): 521–6
[11] Caria MA, Dratman MB, Kow LM, Mameli O, Pavlides C. Thyroid hormone action: Nongenomic modulation of neuronal excitability in the hippocampus. J Neuroendocrinol 2009; 21: 98–107
[12] Carroll T, Raff H, Findling JW. Late-night salivary cortisol measurement in the diagnosis of Cushing’s syndrome. Nat Clin Pract Endocrinol Metab 2008; 4: 344–350
[13] Chung S, Son GH, Kim K. Zirkadian rhythm of adrenal glucocorticoid: its regulation and clinical implications. Biochim Biophys Acta 2011; 1812 (5): 581–591
[14] Costa-e-Sousa RH, Hollenberg AN. Minireview: The Neural Regulation of the Hypothalamic-Pituitary-Thyroid Axis. Endocrinology 2012; 153 (9): 4128–4135
[15] Czeisler CA, Shanahan TL et al. Suppression of melatonin secretion in some blind patients by exposure to bright light. N Engl J Med 1995; 332 (1): 6–11
[16] Czeisler CA, Klerman EB. Zirkadian and sleep-dependent regulation of hormone release in humans. Recent Prog Hormone Res 1999; 54: 97–130 (discussion 130–132)
[17] Dacey DM et al. Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project tot he LGN. Nature 2005; 433, 749–754
[18] Damiola, F, N. Le Minh et al. Restricted feeding uncouples circadian oscillators in peripheral tissues from the central pacemaker in the suprachiasmatic nucleus. Genes Dev 2000; 14 (23): 2950–61
[19] De Kloet CS, Vermetten E, Geuze E et al. Assessment of HPA-axis function in posttraumatic stress disorder: pharmacological and non-pharmacological challenge tests, a review J Psychiatr. Res 2006; 40: 550–567
[20] De la Iglesia HO, Schwartz WJ. Minireview: timely ovulation: circadian regulation of the female hypothalamo-pituitarygonadal axis. Endocrinology 2006; 147: 1148–1153
[21] Dibner C, Schibler U, Albrecht U. The mammalian circadian timing system: organization and coordination of central and peripheral clocks. Annu Rev Physiol 2010; 72: 517–49
[22] Drust B, Waterhouse J, Atkinson G. Circadian rhythms in sports performance-an update. Chronobiology International 2005; 22 (1): 21–44
[23] Dumbell R, Matveeva O, Oster H. Circadian clocks, stress, and immunity. Front Endocrinol 2016; 7: 37
[24] Facer-Childs E, Brandstaetter R, The impact of circadian phenotype and time since awakening on diurnal performance in athletes. Curr Biol 2015; 25: 1–5
[25] Ferrari E, Casarotti B, Muzzoni B et al. Age-related changes of the adrenal secretory pattern: possible role in pathological brain aging. Brain Res Rev 2001; 37: 294–300
[26] Filipski E, Delaunay F, King VM et al. Effects of chronic jet lag on tumor progression in mice. Cancer Res 2004; 64: 7879–7885
[27] Foster RG, Hankins MW et al. Non-rod, non-cone photoreception in the vertebrates. Prog Retin Eye Res 2002; 21 (6): 507–27
[28] Foster RG. Neurobiology: bright blue times. Nature 2005; 433 (7027): 698–9
[29] Fu L, Lee CC. The circadian clock: pacemaker and tumour suppressor. Nat Rev Cancer 2003; 3 (5): 350–361
[30] Garaulet M, Madrid JA. Chronobiology, genetics and metabolic syndrome. Curr Opin Lipidol 2009; 20 (2): 127–34
[31] Gaston, S, Menaker, M et al. Pineal function: the biological clock in the sparrow? Science 1968; 160 (832): 1125–7
[32] Gharbi A, Masmoudi L, Ghorbel S. Time of day effect on soccer-specific field tests in tunisian boy players. Adv Phys Educ 2013; 3, 2: 71–75
[33] Grady SP, Nishino S, Czeisler CA, Hepner D, Scammell TE. Diurnal variation in CSF Orexin-A in healthy male subjects. Sleep 2006; 29: 295–297
[34] Green CB, Takahashi JS, Bass J. The Meter of Metabolism. Cell 2008; 134 (5): 728–742
[35] Hammouda O et al. Time-of-day effects on biochemical responses to soccer-specific endurance in elite Tunisian footballplayers. J Sports Sci 2013; (31) 9: 963–971
[36] Hastings MH, Best JD, Ebling FJP, Maywood ES, McNulty S, Schurov I, Selvage D, Sloper P, Smith KL. Entrainment of the circadian clock. Hypothalamic Integrat Circad Rhyth 1996; 111: 147–174
[37] Hastings MH, Reddy AB et al. Expression of clock gene products in the suprachiasmatic nucleus in relation to circadian behaviour. Novartis Found Symp 2003; 253: 203–17; discussion 102–9, 218–22, 281–4
[38] Hastings M, O’Neill JS, Maywood ES. Zirkadian clocks: regulators of endocrine and metabolic rhythms. J Endocrinol 2007; 195: 187–198
[39] Herzog ED, Aton SJ, Numano R, Sakaki Y, Tei H. Temporal precision in the mammalian circadian system: A reliable clock from less reliable neurons. J Biol Rhyth 2004; 19: 35–46
[40] Honma S, Nakamura W, Shirakawa T, Honma K Diversity in the circadian periods of single neurons of the rat suprachiasmatic nucleus depends on nuclear structure and intrinsic period. Neurosc Lett 2004; 358: 173–176
[41] Horne J, Moseley R. Sudden early-morning awakening impairs immediate tactical planning in a changing ‘emergency’ scenario. J Sleep Res 2011; 20: 275–278
[42] Inouye ST, Kawamura H et al. Persistence of circadian rhythmicity in a mammalian hypothalamic ‘island’ containing the suprachiasmatic nucleus. Proc Natl Acad Sci USA 1979; 76 (11): 5962–6
[43] Ishida A, Mutoh T, Ueyama T et al. Light activates the adrenal gland: timing of gene expression and glucocorticoid release. Cell Metab 2005; 2: 297–307
[44] Kalsbeek A, Fliers E, Franke AN, Wortel J, Buijs RM. Functional connections between the supreachiasmatic nucleus and the thyroid gland as revealed by lesioning and viral tracing techniques in the rat. Endocrinology 2000; 141: 3832–3841
[45] Kanikowska D, Sato M, Witowski J. Contribution of daily and seasonal biorhythms to obesity in humans. Int J Biometeorol 2015; 59 (4): 377–384
[46] Konopka RJ, Benzer S. Clock mutants of Drosophila melanogaster. Proc Natl Acad Sci USA 1971; 68: 2112–2116
[47] Kriegsfeld LJ, Silver R. The regulation of neuroendocrine function: Timing is everything. Horm Behav 2006; 49: 557–574
[48] Lee CC. Tumor suppression by the mammalian Period genes. Cancer Causes Control 2006; 17 (4): 525–530
[49] Lewy A J, T. A. Wehr et al. Light suppresses melatonin secretion in humans. Science 1980; 210 (4475): 1267–9
[50] Long MA, Jutras MJ, Connors BW, Burwell RD. Electrical synapses coordinate activity in the suprachiasmatic nucleus. Nat Neurosci 2005; 8: 61–66
[51] Lucas R J, Foster R G et al. Photoentrainment in mammals: a role for cryptochrome? J Biol Rhyth 1999; 14 (1): 4–10
[52] Luce GG. Biological rhythms in psychology and medicine. Maryland, NIMH; 1970
[53] Madeira MD, Pereira PA, Silva SM, Cadete-Leite A, Paula-Barbosa MM, 2004. Basal forebrain neurons modulate the synthesis and expression of neuropeptides in the rat suprachiasmatic nucleus. Neuroscience 2004; 125: 889–901
[54] Mahoney MM. Shift Work, Jet lag, and female reproduction. international J Endocrinol 2010; 813764
[55] Maywood ES, Reddy AB, Wong GKY, O’Neill JS, O’Brien JA, McMahon DG, Harmar AJ, Okamura H, Hastings MH. Synchronization and maintenance of timekeeping in suprachiasmatic circadian clock cells by neuropeptidergic signaling. Curr Biol 2006; 16: 599- 605
[56] Mondal MS, Nakazato M, Date Y, Murakami N, Hanada R, Sakata T, Matsukura S. Characterization of orexin-A and orexin-B in the microdissected rat brain nuclei and their contents in two obese rat models. Neuroscience Letters 1999; 273: 45–48
[57] Moore RY, Eichler V. B et al. Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat. Brain Res 1972; 42 (1): 201–6
[58] Moore-Ede MC, Czeisler CA, Richardson GS. Circadian timekeeping in health and disease. New Engl J Med 1983; 309: 469–536
[59] Oster H, Damerow S, Kiessling S et al. The circadian rhythm of glucocorticoids is regulated by a gating mechanism residing in the adrenal cortical clock. Cell Metab 2006; 4: 163–173
[60] Panda S, Sato T K et al. Melanopsin (Opn4) requirement for normal light-induced circadian phase shifting. Science 2002; 298 (5601): 2213–2216
[61] Pasquali R, Vicennati V, Cacciari M, Pagotto U. The hypothalamic – pituitary – adrenal axis activity in obesity and the metabolic syndrome. Ann NY Acad Sci 2006; 1083: 111–128
[62] Perreau-Lenz S, Kalsbeek A, Garidou ML, Wortel J, van der Vliet J, van Heijningen C, Simonneaux V, Pevet P, Buijs RM. Suprachiasmatic control of melatonin synthesis in rats: inhibitory and stimulatory mechanisms. European Journal of Neuroscience 2003; 17: 221–228
[63] Pevet P. Melatonin and biological rhythms. Biol Signals Recept 2000; 9 (3–4): 203–212
[64] Pittendrigh CS. Temporal organization: reflections of a Darwinian clockwatcher. Annu Rev Physiol 1993; 55: 16–54
[65] Provencio, I, Rollag MD et al. Photoreceptive net in the mammalian retina. This mesh of cells may explain how some blind mice can still tell day from night. Nature 2002; 415 (6871): 493
[66] Ralph MR, Menaker M. A mutation of the circadian system in golden hamsters. Science 1988; 241 (4870): 1225–7.s
[67] Richter CP. Sleep and activity: their relation to the 24-hour clock. Res Publ Assoc Res Nerv Ment Dis 1967; 45: 8–29
[68] Roenneberg T, Kantermann T, Juda M et al. Light and the human circadian clock. Handbook Exp Pharmacol 2013; 217: 311–331
[69] Saito YC, Maejima T, Nishitani M, Hasegawa E, Yanagawa Y, Mieda M, Sakurai T. Monoamines Inhibit GABAergic Neurons in Ventrolateral Preoptic Area That Make Direct Synaptic Connections to Hypothalamic Arousal Neurons. J Neurosci 2018; 11: 2835–2817
[70] Sakurai T. The neural circuit of orexin (hypocretin): maintaining sleep and wakefulness. Nature Reviews Neuroscience 200/, 8: 171–181
[71] Samuels C. Sleep, recovery, and performance: the new frontier in high-performance athletics. Phys Med Rehabil Clin North Am 2009; 20: 149–159, ix
[72] Sasseville A, Paquet N, Sevigny J, Herbert M. Blue blocker glasses impede the capacity of bright light to suppress melatonin production. J. Pineal Res 2006; 41: 73–78
[73] Schwartz WJ, Davidsen LC et al. In vivo metabolic activity of a putative circadian oscillator, the rat suprachiasmatic nucleus. J Comp Neurol 1980; 189 (1): 157–67
[74] Schwellnus MP, Derman WE, Jordaan E et al. Elite athletes travelling to international destinations >5 time zone differences from their home country have a 2–3-fold increased risk of illness Br J Sports Med 2012; 46: 816–821
[75] Sekaran, S, Foster RG et al. Calcium imaging reveals a network of intrinsically light-sensitive inner-retinal neurons. Curr Biol 2003; 13 (15): 1290–8
[76] Sellix MT, Menaker M. Zirkadian Clocks in the Ovary. Trends Endocrinol Metab (TEM) 2010; 21 (10): 628–636
[77] Shearman LP, Sriram S, Weaver DR, Maywood ES, Chaves I, Zheng BH, Kume K, Lee CC, van der Horst GTJ, Hastings MH, Reppert SM. Interacting molecular loops in the mammalian circadian clock. Science 2000; 288: 1013–1019
[78] Shechter A, Boivin DB. Sleep, hormones, and circadian rhythms throughout the menstrual cycle in healthy women and women with premenstrual dysphoric disorder. Int J Endocrinol 2010; 259345
[79] Stephan FK, Zucker I,. Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions. Proc Natl Acad Sci USA 1972; 69 (6): 1583–6
[80] Stokkan K A, S. Yamazaki et al. Entrainment of the circadian clock in the liver by feeding. Science 291 (5503): 490–3, Storch K F, O. Lipan et al. Extensive and divergent circadian gene expression in liver and heart. Nature 2001; 417 (6884): 78–83
[81] Storch KF, Lipan O et al. Extensive and divergent circadian gene expression in liver and heart. Nature 2002; 417 (6884): 78–83
[82] Ulrich-Lai YM, Arnhold MM, Engeland WC. Adrenal splanchnic innervation contributes to the diurnal rhythm of plasma corticosterone in rats by modulating adrenal sensitivity to ACTH, Am J Physiol Regul Integr Comp Physiol 2006; 290: R1128–R1135
[83] Underwood, H, R. K. Barrett et al. Melatonin does not link the eyes to the rest of the circadian system in quail: a neural pathway is involved. J Biol Rhythms 1990; 5 (4): 349–61
[84] Van der Beek EM, Wiegant VM, van Oudheusden HJC, van der Don HA, van den Hurk R, Buijs RM. Synaptic contacts between gonadotropin-releasing hormone-containing fibers and neurons in the suprachiasmatic nucleus and perichiasmatic area: an anatomical substrate for feedback regulation?. Brain Res 1997; 755 (1): 101–111
[85] Vanecek J, Pavlik A, Illnerova H. Hypothalamic melatonin receptor sites revealed by autoradiography. Brain Res 1987; 435: 359–362,
[86] Welsh D K, Logothetis DE et al. Individual neurons dissociated from rat suprachiasmatic nucleus express independently phased circadian firing rhythms. Neuron 1995; 14 (4): 697–706
[87] Wiegant SJ, Terasawa E. Discrete lesions reveal functional heterogeneity of suprachiasmatic structures in regulation of gonadotropin secretion in the female rat. Neuroendocrinology 1982; 34: 395–404
[88] Yamazaki, S, R. Numano et al. Resetting central and peripheral circadian oscillators in transgenic rats. Science 2000; 288 (5466): 682–5